Эутиреоидный зоб этиология и патогенез
:
:
,
,
. .
. . .
(
— . . )
1.
2.
3.
4.
5.
6.
7.
8.
?
9.
-131
10.
11.
, , , ,
,
, .
1. (
)?
2.
?
3. ,
?
4. , ,
( )?
5. , (
–
)?
,
, , , , – ,
, -, ,
, -, ,
.
. ,
, 22
– ,
15 ? : , ,
30—40%,
, ,
,
, , ?
? 1 ?
1,5 2 ? ,
4 ? 4 , , 3?
– ( ,
.)
?
, – .
, ,
,
.
,
D. A. Koutras [9], : « , ,
.
,
– , , ,
.
– ,
. , , ,
».
, ,
. , 13%
, 1,57 , ,
655 .
5%.
; , ,
4—8 , .
.
,
, .
60 5—6%, – 50%.
.
, ..
, ,
.
90—95% ; — 99%.
(D. Marine, 1880—1976) XX .
. 1917.
,
-, ,
20 5 % [13].
, ,
(. 1).
1
[12]
(/ ) |
0,7-0,9 |
0,4-0,6 |
0,2-0,3 |
0,1-0,2 |
<0,1 |
, .
– ,
—4,
,
, ,
[3]. , ,
,
,
.
,
, ,
, [6].
«
» [3].
—
, L-T4().
, , ,
[4]. , ,
L-T4
, , .
,
L-T4 (. 2). ,
[7, 15].
2
,
, | ( ) | (%) | ||||||
L-T4 | KJ | L-T4+KJ | L-T4 | KJ | L-T4+KJ | |||
Schumm P., | 53 | 14-35 | 100 | 130 | 100+130 | 20 | – | 30 |
Olbricht | 39 | 18-63 | 100 | 500 | – | 28 | 22 | – |
Leisner B., | 55 • | 5-17 | – | 100 | – | – | 37 | – |
Pfannenstiel P., | 74 | 28,1±7,5 | 150 | – | 100+100 | 25 | – | 30 |
Hintze | 166 | 30-60 | 150 | 400 | 75+200 | 32 | 38 | 38 |
Hotze A., | 82 | 18-31 | 100 | – | 100+100 | 24 | 40 | |
Einenkel D., | 30 | 13-15 | 100 | 150 | 50+100 | 42 | 52 | 51 |
, in vitro in vivo, (). ,
.
. 1 –
, ,
1- (-1),
() (),
.
, (). ,
-1 [8]. ,
,
, [5],
-1
[II].
,
,
.
– . . (
18, 25 ) — ,
. ,
, ,
.
,
.
,
( — ) ( 4 – )
. , ,
, , , ,
, .
,
,
. ,
( , ). :
,
, ,
. Guetekunst R. Et al [6] ,
, ,
, , .
.
,
. , ,
, (. 2).
, ,
( 1).
10—80 % .
, .
(
II). III
.
,
,
, ,
. . ,
.
,
, “-
Gs- -,
.
( IV).
; :
.
,
( !)
[10]. ,
, , ,
.
. 2 –
, ,
, ,
.
, , ,
. . , ,
,
. ,
(.
3).
3
Heimann P., | 41 % |
Sanchez F. et. al., 1983 | , |
. ., . .,1979 | , . |
Malamos B. et. al., 1967 | |
Greig W. et. al., | , |
. .
,
.
,
,
.
, ,
. (
18 25 ), , .
, .
,
; –
.
,
.
, ,
, , ,
. . . ,
:
1.
;
2.
;
3.
;
4. ,
, , , (
25 1 ).
.
, :
1. ,
[17]; .. ,
, ,
, ;
2. ,
,
, ;
3. , ,
,
;
4.
(, ,
)
99% [17], .. .
, , :
. . 3 ,
.
.
3 – ,
, « »,
,
.
, ,
. ,
( )
.
:
1)
,
2)
(L-T4),
3)
L-T4.
,
L-T4, ,
, 30%
.
,
( 40—50 ) 100-200 ,
(
).
(. . 2) ,
6 30%.
(
— ,
), ,
.
L-T4
(
, ), ,
, (
0,1—0,4 /, , ,
100—150 L-T4). L-T4, ,
, ,
.
.
L-T4 (. 4).
. 4 –
, 100 L-T4
500
[Olbricht T., Hoff H. G., 1986]
/
1-1,5 :
«» , ,
40 ,
.
,
.
L-T4
L-T4.
( L-T4) L-T4 ( ) ,
,
L-T4.
, L-T4 :
L-T4, 100—200 . , L-T4 , , -4,
(,
«» ). ,
,
(. 5), ,
L-T4
(
, L-T4 KI – ).
, 75—100 L-T4 100—150 .
. 5 – , ,
[Roher H. D., Horster F.
A., 1986]
, , ,
, L-T4 ,
( % )
. , :
L-T4
.
,
L-T4? ,
. ,
() . ,
– .
(
,
,
).
,
.
,
: , , ,
.
(
)
, ,
, .
,
(100—200 ) ,
, .
, ,
, , ,
,
.
. , ,
, . , 50—60
.
,
, L-T4,
, , ,
, , – ,
. , 60
,
1—2 . – ,
:
;
, — ;
L-T4,
, –
, ;
L-T4,
, — ;
, L-T4,
[2].
?
, .
, , ,
40 % , ,
, .
,
.
, , ,
L-T4. ,
(..
), , , .
() : « L-T4
. ,
,
. .
L-T4 » [1].
– ? ,
. ,
.
,
. , ,
, – .
-131
,
/
.
, ,
,
( 4—5 ). ,
, ,
.
, ,
,
( ).
-131 .
40—50 %
(. 4).
4
, | – | () | (%) | (n) | |
Kay | 14 | 20-100 | 1-2 | 79 | – |
Hegedus L., | 25 | 7-28 | 1 | 41 | 3 |
Verelst J., | 15 | 20-50 | 8 | 39 | 15 |
Nygaard B., | 69 | 4-30 | 10 | 55 | 15 |
Huysmans | 17 | 37-150 | 1 | 40 | – |
Wesche M. F., et al., 1995 | 10 | 14-65 | 1-6 | 48 | 4 |
Howarth D. M., et al., 1997 | 38 | 60 | 4 | 92 | 25 |
-131
. , ,
.
, ,
(
) , (
— , ).
,
,
. ,
() .
.
,
, . ,
20
80 %.
. 6. ,
, ,
, .
, :
L-T4, ,
.
10 ,
200 .
(
),
,
«» 1—1,5 ,
. ,
( )
( ),
-4 0,3—0,8
/.
3—10 ,
L-T4.
.
6 –
, ,
200
.
. ,
, ,
L-T4. , (. . ,
)
( + 4) , ,
.
1. AACE clinical practice guidelines for the diagnosis
and management of thyroid nodules // Endocrine Practice. 1996.VoL2.Nol P. 78-84.
2. Bauer B.C., Ettinger B., Nevitt M.C., Stone K.L.Wsk
for fracture in women with low serum levels of thyroid-stimulating hormone //
Annals of Internal Medicine. 2001. Vol. 134. P. 561-568.
3. Bray G. A. Increased sensitivity of the thyroid
in iodinedepleted rats to the goitrogenic effects of thyrotropin // J.Clin.
Investigation. 1968. Vol. 47. P. 1640-1647.
4. Gartner R. Strumatherapie mit Schilddrusenhormon
oder Jodid? // Dtsch. Med. Wochenschr. 1987. Bd.
112. S. 987-989.
5. Gartner R., Greil W., Demharter R., Horn K.
Involvement of cyclic AMP, iodide and metabolites of arachidonic acid in the
regulation of cell proliferation of isolated porcine thyroid follicles // Molec.
Cell. Endocrinol. 1985. Vol. 42. P. 145-155.
6. Gutekunst R., Smolarek H., Hasenpusch U. et
al. Goitre epidemiology: thyroid volume, iodine excretion, thyroglobulin and thyrotropin
in Germany and Sweden // Acta Endocrinol. 1986. Vol. 112. P. 494-501.
7. Hintze G., Emrich D., Kobberling J. Treatment
of endemic goitre due to iodine deficiency with iodine, levothyroxine or both:
results of a multicentre trial // Eur. J. Clin. Invest. 1989. Vol. 19. P. 527-534.
8. Hofbauer L.C., Rafferzeder M., Janssen O.E., Gartner
R. Insulin-like growth factor I messenger ribonucleic acid expression in
porcine thyroid follicles is regulated bythyrotropin and iodine // Eur.
J. Endocrinol. 1995.Vol. 132. P. 605-610.
9. Koutras D. A. The medical treatment of non-toxic
goiter: several questions remain // Thyroidol. Clin. Exp. 1993. Vol. 5. P. 49-55.
10. LaurbergP., NyhrS. B., Pedersen K. M. et
al. Thyroid disorders in mild iodine deficiency // Thyroid. 2000. Vol. 10. P.
951-963.
11. MacielR.M., MosesA.C., Villone G. et al.
Demonstration of the production and physiological role of insulin-like growth
factor II in rat thyroid follicular cells in culture // J. Clin. Invest. 1988.
Vol. 82. P. 1546-1553.
12. Marine D. The pathogenesis and prevention
of simple or endemic goiter//JAMA. 1935. Vol. 104. P. 2334.
13. Marine D., Kimball 0. P. Prevention of simple
goiter in man // Arch. Intern. Med. 1920. Vol. 25. P. 661-672.
14. Olbricht T., HoffH. G. lodid in der Therapie
von Schilddrusenerkrankungen // Internistische Welt. 1986. Bd. 7. S. 223-229.
15. Pfannenstiel P. Therapie der endemischen
Struma mit Levothyroxin und Jodid. Ergebnisse einer multizentrischen Studie
// Dtsch. Med. Wochenschr. 1988. Vol. 113. P. 326-331.
16. Roher H. D., Horster F. A. Therapie einer
Funktionsstorung nach Schilddrusenoperation // Dtsch. Med. Wochenschr. 1986.
Bd.1 U.S. 674-676.
17. Schlumberger M., Pacini F. Thyroid tumors.
Paris, 1999.
« ».
. 1. 2003 №1
”
”
Ü
Источник
Диффузный эутиреоидный зоб – компенсаторная гипертрофия и гиперплазия щитовидной железы без нарушения ее функции. Диффузный эутиреоидный зоб, как правило, не имеет выраженных клинических проявлений; при значительном увеличении щитовидной железы может ощущаться давление в области шеи, иметь место видимый косметический дефект. Диагностика диффузного эутиреоидного зоба предполагает проведение пальпации железы, УЗИ, сцинтиграфии, пункционной биопсии, определение уровня ТТГ. В зависимости от степени выраженности, лечение диффузного эутиреоидного зоба может включать назначение препаратов йода, супрессивную терапию левотироксином, терапию радиоактивным йодом.
Общие сведения
Диффузный эутиреоидный зоб – заболевание щитовидной железы, сопровождающееся увеличением ее объема (у мужчин более 25 мл, у женщин – свыше 18 мл) без нарушения функциональной активности. Увеличение объема щитовидной железы при диффузном эутиреоидном зобе носит компенсаторный характер и направлено на поддержание в организме необходимого уровня тиреоидных гормонов. Диффузный эутиреоидный зоб сопровождается пальпируемым и/или видимым увеличением щитовидной железы.
Ведущим фактором, определяющим распространенность диффузного эутиреоидного зоба, является уровень потребления йода населением того или иного региона. По данным ВОЗ, различные йододефицитные заболевания щитовидной железы имеются у 13% населения планеты. При этом в регионах с достаточным потреблением йода случаи диффузного эутиреоидного зоба носят спорадический характер; в местностях с йододефицитом – эндемический характер (более 5% в популяции). Чаще всего диффузный эутиреоидный зоб развивается в возрасте 20-30 лет; у женщин данное состояние возникает в 2–3 раза чаще, обычно в периоды повышенной потребности в йоде (во время полового созревания, беременности, лактации).

Диффузный эутиреоидный зоб
Причины
В 90-95% случаев причиной диффузного эутиреоидного зоба служит йодный дефицит. При этом гипертрофические и гиперпластические процессы в щитовидной железе носят компенсаторный характер, призванный обеспечить организм необходимым уровнем тиреоидных гормонов.
Кроме йодного дефицита, развитию диффузного эутиреоидного зоба способствуют курение, эмоциональные стрессы, хронические инфекции, прием некоторых медикаментов, недостаток микроэлементов (марганца, цинка, селена, кобальта, меди, молибдена), избыток кальция. Определенное значение в этиологии заболевания отводится возрасту, полу, наследственной предрасположенности.
Случаи спорадического зоба обусловлены врожденными дефектами ферментных систем, участвующих в синтезе тиреоидных гормонов. В целом развитие диффузного эутиреоидного зоба связано с множеством факторов, которые в настоящее время еще не до конца изучены.
Патогенез
Адаптационные механизмы к йододефициту связаны с усилением активного захвата йода щитовидной железой, преимущественным синтезом трийодтиронина (Т3), уменьшением секреции йодида почками и реутилизацией эндогенного йода с целью биосинтеза тиреоидных гормонов. Таким образом организму удается компенсировать дефицит йода, однако при этом развивается гипертрофия тиреоцитов, обеспечивающая сохранность функции щитовидной железы.
В патогенезе диффузного эутиреоидного зоба играют роль аутокринные ростовые факторы (инсулиноподобный фактор роста 1-го типа, эпидермальный фактор роста, фактор роста фибробластов), которые при снижении уровня йода оказывают стимулирующее действие на тироциты. Согласно современным представлениям, при йодном дефиците влияние ТТГ (тиреотропного гормона) на щитовидную железу также опосредовано аутокринными факторами роста.
Классификация
В эндокринологии выделяют диффузный, узловой, многоузловой и смешанный (диффузно-узловой) эутиреоидный зоб. По рекомендации ВОЗ, степень выраженности зоба оценивается пальпаторно по следующим критериям:
- 0 степень – данных за зоб нет; размер каждой доли щитовидной железы не превышает размеры дистальной фаланги большого пальца больного;
- 1 степень – зоб определяется пальпаторно, однако не виден при обычном положении шеи;
- 2 степень — зоб определяется пальпаторно и визуально при обычном положении шеи.
Симптомы диффузного зоба
Функция щитовидной железы при диффузном эутиреоидном зобе практически не страдает, поэтому клинические проявления в большинстве случаев также не развиваются. Реже может отмечаться повышенная утомляемость и общая слабость, головная боль. При больших степенях увеличения щитовидной железы возможно ощущение давления в области шеи, наличие видимого косметического дефекта.
Осложнения
Осложнения диффузного эутиреоидного и других форм зоба встречаются при значительной гипертрофии щитовидной железы. Они могут выражаться компрессией трахеи, пищевода, прилежащих нервных стволов и сосудов; развитием синдрома верхней полой вены; кровоизлияниями в ткань щитовидной железы; струмитом (воспалением железы, сходным по клиническим проявлениям с подострым тиреоидитом) и т. д. Нередко на фоне диффузного эутиреоидного зоба в последующем развивается узловой зоб, эутиреоидный или токсический зоб.
Диагностика
Первичное представление о размерах щитовидной железы получают в процессе пальпации осмотра шеи. Для уточнения информации о размерах, объеме и структуре органа проводится:
- УЗИ щитовидной железы. Диффузный эутиреоидный зоб диагностируется при объеме щитовидной железы более 25 мл у мужчин и 18 мл у женщин.
- Биопсия. Если по данным эхоскопии обнаруживаются дополнительные узловые образования, показано проведение тонкоигольной пункционной биопсии (для исключения рака щитовидной железы).
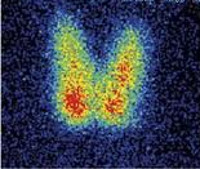
- Радионуклидная диагностика. Сцинтиграфия при диффузном увеличении железы выявляет равномерное распределение изотопа; при узловой форме определяются «холодные» или «теплые» узлы.
Среди лабораторных данных при диффузном эутиреоидном зобе наибольший диагностический интерес представляют показатели Т3, Т4, ТТГ, тиреоглобулина. У эутиреодных пациентов Т3 и Т4 находятся в пределах нормы, иногда отмечается некоторое увеличение уровня Т3 при снижении Т4 и нормальных показателях ТТГ. Содержание тиреоглобулина в крови при йодном дефиците увеличивается. При исследовании иммунограммы определяются уровни иммуноглобулинов, Т и В-лимфоцитов, АТ к тиреоглобулину, АТ к микросомальной фракции тироцитов. В случае наличия клинических признаков сдавления пищевода зобом больших размеров проводится рентгенография пищевода.

КТ ОГК. Диффузное увеличение щитовидной железы, пациент в состоянии эутиреоза.
Лечение диффузного эутиреоидного зоба
В настоящее время для консервативного лечения диффузного эутиреоидного зоба используют:
- монотерапию препаратами йода
- супрессивную терапию левотироксином
- комбинированную терапию йодом и левотироксином.
У детей, подростков и взрослых моложе 40-50 лет лечение начинают с монотерапии препаратами йода (калия йодид), что в течение полугода обычно приводит к уменьшению объема щитовидной железы до физиологических размеров. При отсутствии динамики в течение 6 месяцев монотерапии йодом, решается вопрос о переходе на супрессивную монотерапию препаратами левотироксина (L-Т4) или комбинированную терапию препаратами йодида калия и левотироксина.
Оперативное лечение может быть показано при гигантских размерах зоба и компрессии окружающих органов. Альтернативным методом лечения диффузного эутиреоидного зоба служит терапия радиоактивным йодом-131, с помощью которой достигается уменьшение объема щитовидной железы на 40-50 % уже после однократного введения изотопа.
Прогноз
В большинстве случаев с помощью этиотропного лечения объем щитовидной железы удается нормализовать. У части пациентов на фоне диффузного эутиреоидного зоба формируются узловые образования с функциональной автономией. Пациенты с диффузным эутиреоидным зобом старше 45–50 лет должны находиться под динамическим наблюдением эндокринолога, проходить ежегодное УЗИ щитовидной железы и определение уровня ТТГ.
Профилактика
Профилактика диффузного эутиреоидного зоба делится на массовую и индивидуальную. Массовая профилактика заключается в употреблении в пищу йодированной соли, продуктов, богатых йодом (морской капусты, морской рыбы и др. морепродуктов, грецких орехов, хурмы и т. д.).
Индивидуальная профилактика проводится путем специального назначения препаратов йода лицам из групп риска по развитию диффузного эутиреоидного зоба: беременным, проживающим в регионах йодного дефицита, пациентам, перенесшим операцию на щитовидной железе и др. Для профилактики спорадических случаев диффузного эутиреоидного зоба необходимо ограничение и исключение воздействия струмогенных факторов.
Источник